Regulación de pruebas genéticas
A medida que la ciencia de la genómica avanza, las pruebas genéticas se están convirtiendo en algo más común en la práctica clínica. Aún así, la mayoría de las pruebas genéticas no son reguladas, lo cual significa que están disponibles en el mercado sin ningún análisis independiente para verificar las menciones expresas del vendedor sobre las pruebas.
Panorama general de las pruebas genéticas
La Administración de Alimentos y Medicamentos (Food and Drug Administration, FDA) de EE.UU. tiene la autoridad de regular las pruebas genéticas, pero a la fecha sólo ha regulado el relativamente pequeño número de pruebas genéticas vendidas a los laboratorios como kits. Si bien los Centros de Servicios de Medicare y Medicaid (Centers for Medicare and Medicaid Services, CMS) regulan los laboratorios clínicos, no examinan si las pruebas realizadas son o no clínicamente significativas. Desde la década de los 90, paneles de expertos y miembros del Congreso de EE.UU. han expresado preocupación sobre esta carencia regulatoria y la necesidad de que sea abordada por la FDA. En respuesta, en el 2010 la FDA anunció planes para ampliar su regulación a todas las pruebas genéticas; a la fecha, esta ampliación no ha tomado lugar. Mientras tanto, la FDA continúa regulando los kits de pruebas, y ha comenzado a regular las herramientas genómicas en las investigaciones clínicas.
-
Panorama general de las pruebas genéticas
La Administración de Alimentos y Medicamentos (Food and Drug Administration, FDA) de EE.UU. tiene la autoridad de regular las pruebas genéticas, pero a la fecha sólo ha regulado el relativamente pequeño número de pruebas genéticas vendidas a los laboratorios como kits. Si bien los Centros de Servicios de Medicare y Medicaid (Centers for Medicare and Medicaid Services, CMS) regulan los laboratorios clínicos, no examinan si las pruebas realizadas son o no clínicamente significativas. Desde la década de los 90, paneles de expertos y miembros del Congreso de EE.UU. han expresado preocupación sobre esta carencia regulatoria y la necesidad de que sea abordada por la FDA. En respuesta, en el 2010 la FDA anunció planes para ampliar su regulación a todas las pruebas genéticas; a la fecha, esta ampliación no ha tomado lugar. Mientras tanto, la FDA continúa regulando los kits de pruebas, y ha comenzado a regular las herramientas genómicas en las investigaciones clínicas.
Introducción a las pruebas genéticas
El término "pruebas genéticas" abarca una serie de técnicas que incluyen el análisis de ADN, ARN o proteínas humanas. Las pruebas genéticas se usan como una herramienta de atención de la salud para detectar variantes genéticas asociadas con una enfermedad o afección específica, así como para usos no clínicos tales como pruebas de paternidad y asuntos forenses. En el entorno clínico, pueden hacerse pruebas genéticas para determinar la causa genética de una enfermedad, confirmar un presunto diagnóstico, predecir una futura enfermedad, detectar cuando un individuo pudiera pasar una mutación genética a sus hijos y predecir la respuesta a un tratamiento. También se usan para detectar defectos genéticos en recién nacidos, fetos o embriones utilizados en la fecundación in vitro.
Las primeras pruebas genéticas fueron para la detección de anomalías cromosómicas (ver cariotipo) y mutaciones en genes individuales que causan trastornos hereditarios poco frecuentes, tales como la fibrosis quística. En los últimos años, sin embargo, se ha ampliado mucho la variedad de pruebas. Ahora hay pruebas que incluyen análisis complejos de varios genes para, por ejemplo, identificar el riesgo personal de tener enfermedades crónicas tales como enfermedades del corazón y el cáncer, o para cuantificar el riesgo de un paciente de la reaparición del cáncer. También hay muchas pruebas para predecir la eficacia de tratamientos y guiar su administración. Además, el Instituto Nacional de Investigación del Genoma Humano (National Human Genome Research Institute, NHGRI) está realizando investigaciones para hacer posible el uso clínico de series de pruebas multi-génicas, la secuenciación completa del exoma (el análisis de todos los genes de un paciente), y la secuenciación completa del genoma (el análisis del código genético completo de un paciente), para detectar, por ejemplo, la causa de una enfermedad no diagnosticada o de un tumor canceroso.
-
Introducción a las pruebas genéticas
El término "pruebas genéticas" abarca una serie de técnicas que incluyen el análisis de ADN, ARN o proteínas humanas. Las pruebas genéticas se usan como una herramienta de atención de la salud para detectar variantes genéticas asociadas con una enfermedad o afección específica, así como para usos no clínicos tales como pruebas de paternidad y asuntos forenses. En el entorno clínico, pueden hacerse pruebas genéticas para determinar la causa genética de una enfermedad, confirmar un presunto diagnóstico, predecir una futura enfermedad, detectar cuando un individuo pudiera pasar una mutación genética a sus hijos y predecir la respuesta a un tratamiento. También se usan para detectar defectos genéticos en recién nacidos, fetos o embriones utilizados en la fecundación in vitro.
Las primeras pruebas genéticas fueron para la detección de anomalías cromosómicas (ver cariotipo) y mutaciones en genes individuales que causan trastornos hereditarios poco frecuentes, tales como la fibrosis quística. En los últimos años, sin embargo, se ha ampliado mucho la variedad de pruebas. Ahora hay pruebas que incluyen análisis complejos de varios genes para, por ejemplo, identificar el riesgo personal de tener enfermedades crónicas tales como enfermedades del corazón y el cáncer, o para cuantificar el riesgo de un paciente de la reaparición del cáncer. También hay muchas pruebas para predecir la eficacia de tratamientos y guiar su administración. Además, el Instituto Nacional de Investigación del Genoma Humano (National Human Genome Research Institute, NHGRI) está realizando investigaciones para hacer posible el uso clínico de series de pruebas multi-génicas, la secuenciación completa del exoma (el análisis de todos los genes de un paciente), y la secuenciación completa del genoma (el análisis del código genético completo de un paciente), para detectar, por ejemplo, la causa de una enfermedad no diagnosticada o de un tumor canceroso.
Regulación federal de pruebas genéticas
Tres agencias federales desempeñan una función en la regulación de las pruebas genéticas: el CMS, la FDA y la Comisión Federal de Comercio (Federal Trade Commission, FTC).
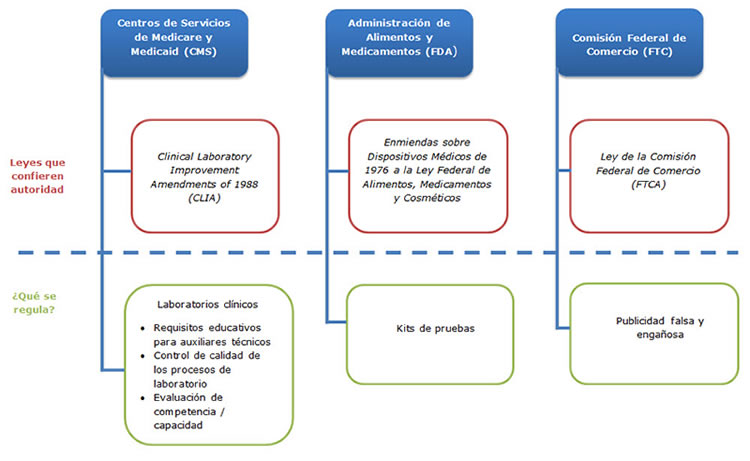
El CMS es responsable de regular todos los laboratorios clínicos que hacen pruebas genéticas, para asegurar su cumplimiento con las Enmiendas para Mejoras de Laboratorios Clínicos (Clinical Laboratory Improvements Amendments, CLIA) de 1988. El objetivo de CLIA es certificar la calidad de las pruebas clínicas, incluida la verificación de los procedimientos utilizados y la capacidad de los técnicos que procesan las pruebas. También abarca la evaluación de competencia / capacidad para algunas pruebas.
Cómo se evalúa una prueba genética:
- ¿Es la prueba exacta y fiable? (Validez analítica)
- ¿Es médicamente significativo el resultado de la prueba? (Validez clínica)
- ¿Mejora la prueba la atención de la salud? (Utilidad clínica)
La FDA posee la autoridad más extensa en términos de regulación de la seguridad y eficacia de las pruebas genéticas como dispositivos médicos bajo la Ley Federal de Alimentos, Medicamentos y Cosméticos (Federal Food, Drug, and Cosmetic Act). El hecho de que la FDA regule o no una prueba se determina mediante cómo se introduce la prueba al mercado. Una prueba puede comercializarse como un "kit" de pruebas comercial, un grupo de reactivos utilizados en el procesamiento de muestras genéticas que se empaquetan juntos y se venden a múltiples laboratorios. Más comúnmente, una prueba se introduce al mercado como una prueba desarrollada por un laboratorio (laboratory-developed test, LDT); en tal caso, la prueba es desarrollada y realizada por un solo laboratorio, y las muestras se envían a ese laboratorio para ser analizadas. La FDA regula solamente las pruebas vendidas como kits y, a la fecha, ha practicado "discreción en la aplicación" para las LDT.
El grado de supervisión de la FDA de una prueba genética se basa en su fin previsto y en los riesgos que representa un resultado inexacto de la prueba. La FDA clasifica los dispositivos médicos, incluidas las pruebas genéticas, en tres clases separadas, que varían desde la clase I, para los productos de riesgo relativamente bajo, hasta la clase III, donde las pruebas se someten al nivel más alto de escrutinio. Puede encontrarse aquí una lista completa de pruebas genéticas humanas aprobadas.
La supervisión por parte de la FDA también incluye la farmacogenómica, que es el uso de información genómica para ayudar a predecir cómo pudiera un individuo responder a un medicamento específico, para identificar individuos que pudieran tener una reacción adversa al tomar un medicamento o para ayudar en la selección de la dosis óptima de un medicamento. Parte de la supervisión por parte de la FDA de los medicamentos comercializados es para asegurar que los fabricantes presenten información en etiquetas de medicamentos acerca de marcadores genéticos, que sea pertinente para la seguridad y eficacia del medicamento. Puede encontrarse aquí una lista de medicamentos farmacogenómicos aprobados.
En comparación con la FDA y el CMS, la autoridad regulatoria de la FTC es relativamente estrecha, y se limita a cómo se anuncian las pruebas. La Comisión tiene la autoridad de regular la publicidad que comunica información relacionada con la salud a los consumidores para asegurar que no sea falsa o engañosa.
-
Regulación federal de pruebas genéticas
Tres agencias federales desempeñan una función en la regulación de las pruebas genéticas: el CMS, la FDA y la Comisión Federal de Comercio (Federal Trade Commission, FTC).

El CMS es responsable de regular todos los laboratorios clínicos que hacen pruebas genéticas, para asegurar su cumplimiento con las Enmiendas para Mejoras de Laboratorios Clínicos (Clinical Laboratory Improvements Amendments, CLIA) de 1988. El objetivo de CLIA es certificar la calidad de las pruebas clínicas, incluida la verificación de los procedimientos utilizados y la capacidad de los técnicos que procesan las pruebas. También abarca la evaluación de competencia / capacidad para algunas pruebas.
Cómo se evalúa una prueba genética:
- ¿Es la prueba exacta y fiable? (Validez analítica)
- ¿Es médicamente significativo el resultado de la prueba? (Validez clínica)
- ¿Mejora la prueba la atención de la salud? (Utilidad clínica)
La FDA posee la autoridad más extensa en términos de regulación de la seguridad y eficacia de las pruebas genéticas como dispositivos médicos bajo la Ley Federal de Alimentos, Medicamentos y Cosméticos (Federal Food, Drug, and Cosmetic Act). El hecho de que la FDA regule o no una prueba se determina mediante cómo se introduce la prueba al mercado. Una prueba puede comercializarse como un "kit" de pruebas comercial, un grupo de reactivos utilizados en el procesamiento de muestras genéticas que se empaquetan juntos y se venden a múltiples laboratorios. Más comúnmente, una prueba se introduce al mercado como una prueba desarrollada por un laboratorio (laboratory-developed test, LDT); en tal caso, la prueba es desarrollada y realizada por un solo laboratorio, y las muestras se envían a ese laboratorio para ser analizadas. La FDA regula solamente las pruebas vendidas como kits y, a la fecha, ha practicado "discreción en la aplicación" para las LDT.El grado de supervisión de la FDA de una prueba genética se basa en su fin previsto y en los riesgos que representa un resultado inexacto de la prueba. La FDA clasifica los dispositivos médicos, incluidas las pruebas genéticas, en tres clases separadas, que varían desde la clase I, para los productos de riesgo relativamente bajo, hasta la clase III, donde las pruebas se someten al nivel más alto de escrutinio. Puede encontrarse aquí una lista completa de pruebas genéticas humanas aprobadas.
La supervisión por parte de la FDA también incluye la farmacogenómica, que es el uso de información genómica para ayudar a predecir cómo pudiera un individuo responder a un medicamento específico, para identificar individuos que pudieran tener una reacción adversa al tomar un medicamento o para ayudar en la selección de la dosis óptima de un medicamento. Parte de la supervisión por parte de la FDA de los medicamentos comercializados es para asegurar que los fabricantes presenten información en etiquetas de medicamentos acerca de marcadores genéticos, que sea pertinente para la seguridad y eficacia del medicamento. Puede encontrarse aquí una lista de medicamentos farmacogenómicos aprobados.
En comparación con la FDA y el CMS, la autoridad regulatoria de la FTC es relativamente estrecha, y se limita a cómo se anuncian las pruebas. La Comisión tiene la autoridad de regular la publicidad que comunica información relacionada con la salud a los consumidores para asegurar que no sea falsa o engañosa.
Regulación de la FDA y la investigación genómica
El Congreso de EE.UU. otorgó a la FDA autoridad para supervisar el uso de dispositivos médicos en las investigaciones clínicas en las mismas Enmiendas de 1976 para Dispositivos Médicos en que autorizó su revisión de dispositivos comercializados antes de su introducción al mercado. A diferencia de la discreción en la aplicación puesta en la práctica en el ámbito de las pruebas genéticas comerciales, la agencia nunca ha diferenciado entre LDT y kits en el ejercicio de esta autoridad en el uso de dispositivos genéticos dentro de las investigaciones clínicas.
Con las series de pruebas con objetivos seleccionados, genomas y exomas de las plataformas de secuenciación avanzadas que se están poniendo a prueba ahora en los entornos clínicos, algunos estudios que incluyan estas tecnologías necesitarán una Exención para dispositivos experimentales (Investigational Device Exemptions, IDE) de la FDA antes de que puedan inscribir a participantes. La IDE, similar a la solicitud de un Nuevo medicamento bajo investigación (Investigational New Drug, IND), está diseñada para asegurar que haya una supervisión adecuada del uso en investigaciones de nuevos dispositivos médicos que no hayan recibido el visto bueno o aprobación de la FDA. Requiere que los investigadores proporcionen a la FDA información sobre el dispositivo que esté siendo usado en el estudio, incluida la validez analítica para la finalidad prevista por los investigadores (es decir, si la prueba mide lo que los investigadores creen que mide).
-
Regulación de la FDA y la investigación genómica
El Congreso de EE.UU. otorgó a la FDA autoridad para supervisar el uso de dispositivos médicos en las investigaciones clínicas en las mismas Enmiendas de 1976 para Dispositivos Médicos en que autorizó su revisión de dispositivos comercializados antes de su introducción al mercado. A diferencia de la discreción en la aplicación puesta en la práctica en el ámbito de las pruebas genéticas comerciales, la agencia nunca ha diferenciado entre LDT y kits en el ejercicio de esta autoridad en el uso de dispositivos genéticos dentro de las investigaciones clínicas.
Con las series de pruebas con objetivos seleccionados, genomas y exomas de las plataformas de secuenciación avanzadas que se están poniendo a prueba ahora en los entornos clínicos, algunos estudios que incluyan estas tecnologías necesitarán una Exención para dispositivos experimentales (Investigational Device Exemptions, IDE) de la FDA antes de que puedan inscribir a participantes. La IDE, similar a la solicitud de un Nuevo medicamento bajo investigación (Investigational New Drug, IND), está diseñada para asegurar que haya una supervisión adecuada del uso en investigaciones de nuevos dispositivos médicos que no hayan recibido el visto bueno o aprobación de la FDA. Requiere que los investigadores proporcionen a la FDA información sobre el dispositivo que esté siendo usado en el estudio, incluida la validez analítica para la finalidad prevista por los investigadores (es decir, si la prueba mide lo que los investigadores creen que mide).
Planes de la FDA para regular las LDT
En el 2010, la FDA anunció que tiene previsto regular las LDT, citando las maneras en que ha cambiado el mercado, tal como la creciente distancia entre los laboratorios comerciales que hacen las pruebas y el médico que las ordena, y el aumento en la complejidad de algunas de las pruebas genéticas.
El anuncio de la FDA se generó después de repetidas peticiones al paso de muchos años por parte de paneles asesores para que la FDA regulara las LDT. Desde 1997, un grupo mixto de acción especial del NIH y el Departamento de Energía, sobre pruebas genéticas, recomendó la formación de un comité para asesorar al secretario del Departamento de Salud y Servicios Humanos (Department of Health and Human Services, HHS) sobre ésta y otras cuestiones asociadas. El comité resultante, el Comité Asesor del Secretario sobre Pruebas Genéticas, pidió a la FDA en el 2000 que revisara pruebas para determinar su valor diagnóstico o pronóstico antes de permitir su introducción en el mercado, y un año después presentó más recomendaciones sobre cómo clasificar mejor las pruebas para evaluación. El sucesor del comité, el Comité Asesor del Secretario sobre Genética, Salud y Sociedad, publicó otro informe en el 2008 recomendando nuevamente que la FDA regulara todas las pruebas de laboratorio, sin importar si se vendían como kits o se comercializaban como LDT.
Estas recomendaciones no fueron implementadas, pero el tema fue recalcado nuevamente cuando una investigación realizada en el 2006 por la Oficina de Rendición de Cuentas del Gobierno (Government Accountability Office, GAO) sobre las pruebas genéticas comercializadas directamente al consumidor, llamó a muchas de las pruebas escudriñadas "médicamente no comprobadas y sin sentido" y engañosas para los consumidores. El senador Edward Kennedy (D-MA), junto con el senador Gordon Smith (R-OR), redactaron en el 2006 la Ley de Mejora de Análisis de Laboratorio (Laboratory Test Improvement Act) para extender la supervisión de la FDA a todas las pruebas clínicas de laboratorio. Luego, el senador Barack Obama (D-IL), con el copatrocinio del senador Richard Burr (R-NC), también introdujo la Ley de la Genómica y la Medicina Personalizada (Genomics and Personalized Medicine Act), con disposiciones para fortalecer la regulación de las pruebas genéticas. A pesar del patrocinio bipartito de ambos proyectos de leyes, ambos carecieron del apoyo necesario para lograr avances en el Congreso de EE.UU. La GAO volvió a considerar el asunto en el 2010 con un informe sobre las prácticas engañosas de las pruebas comercializadas directamente al consumidor, refiriéndose a los resultados de tales pruebas como "engañosos y de poca utilidad o sin utilidad práctica".
El 31 de julio de 2014, la FDA dio aviso al Congreso de que anunciaría un proyecto de directrices sobre la regulación de pruebas desarrolladas por laboratorios (LDT) en los siguientes 60 días.
-
Planes de la FDA para regular las LDT
En el 2010, la FDA anunció que tiene previsto regular las LDT, citando las maneras en que ha cambiado el mercado, tal como la creciente distancia entre los laboratorios comerciales que hacen las pruebas y el médico que las ordena, y el aumento en la complejidad de algunas de las pruebas genéticas.
El anuncio de la FDA se generó después de repetidas peticiones al paso de muchos años por parte de paneles asesores para que la FDA regulara las LDT. Desde 1997, un grupo mixto de acción especial del NIH y el Departamento de Energía, sobre pruebas genéticas, recomendó la formación de un comité para asesorar al secretario del Departamento de Salud y Servicios Humanos (Department of Health and Human Services, HHS) sobre ésta y otras cuestiones asociadas. El comité resultante, el Comité Asesor del Secretario sobre Pruebas Genéticas, pidió a la FDA en el 2000 que revisara pruebas para determinar su valor diagnóstico o pronóstico antes de permitir su introducción en el mercado, y un año después presentó más recomendaciones sobre cómo clasificar mejor las pruebas para evaluación. El sucesor del comité, el Comité Asesor del Secretario sobre Genética, Salud y Sociedad, publicó otro informe en el 2008 recomendando nuevamente que la FDA regulara todas las pruebas de laboratorio, sin importar si se vendían como kits o se comercializaban como LDT.
Estas recomendaciones no fueron implementadas, pero el tema fue recalcado nuevamente cuando una investigación realizada en el 2006 por la Oficina de Rendición de Cuentas del Gobierno (Government Accountability Office, GAO) sobre las pruebas genéticas comercializadas directamente al consumidor, llamó a muchas de las pruebas escudriñadas "médicamente no comprobadas y sin sentido" y engañosas para los consumidores. El senador Edward Kennedy (D-MA), junto con el senador Gordon Smith (R-OR), redactaron en el 2006 la Ley de Mejora de Análisis de Laboratorio (Laboratory Test Improvement Act) para extender la supervisión de la FDA a todas las pruebas clínicas de laboratorio. Luego, el senador Barack Obama (D-IL), con el copatrocinio del senador Richard Burr (R-NC), también introdujo la Ley de la Genómica y la Medicina Personalizada (Genomics and Personalized Medicine Act), con disposiciones para fortalecer la regulación de las pruebas genéticas. A pesar del patrocinio bipartito de ambos proyectos de leyes, ambos carecieron del apoyo necesario para lograr avances en el Congreso de EE.UU. La GAO volvió a considerar el asunto en el 2010 con un informe sobre las prácticas engañosas de las pruebas comercializadas directamente al consumidor, refiriéndose a los resultados de tales pruebas como "engañosos y de poca utilidad o sin utilidad práctica".
El 31 de julio de 2014, la FDA dio aviso al Congreso de que anunciaría un proyecto de directrices sobre la regulación de pruebas desarrolladas por laboratorios (LDT) en los siguientes 60 días.
Last updated: December 31, 1969
